
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demop - தொகுதி தனிமங்கள்:
இத்தொகுதி தனிமங்கள் அட்டவணையில் 13 முதல் 18 தொகுதிகள் வரை இடம்பெற்றுள்ளன. இத்தொகுதி தனிமங்களின் கடைசி எலக்ட்ரான் ஆனாது p துணைக்கூட்டில் வைக்கப்படுகிறது. இத்தொகுதியில் போரான், கார்பன், நைட்ரஜன், ஆக்ஸிஜன், புளுரின் குடும்பம் மற்றும் மந்த வாயுக்கள் (ஹீலியம் தவிர) அடங்கும். இவை பிரதிநிதித்துவ தனிமங்கள் என்று அழைக்கப்படுகின்றன. p தொகுதி பெரிய அளவில் பல்வேறுபட்ட தனிமங்களின் சங்கமமாகும். இந்த ஒரு தொகுதியில் மட்டுமே உலோகங்கள், அலோகங்கள் மற்றும் உலோகப் போலிகள் என்ற மூன்று வகை தனிமங்களும் காணப்படுகின்றன.
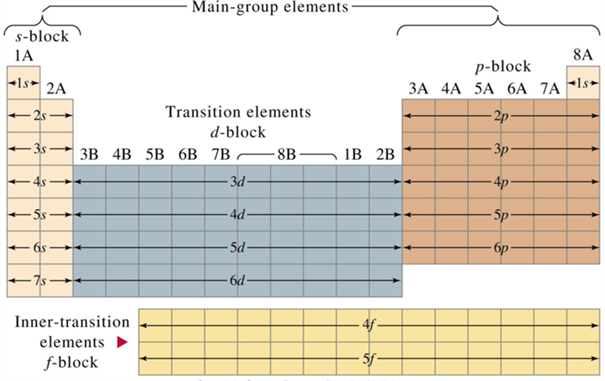
s, p, d மற்றும் f தொகுதி தனிமங்கள்
d - தொகுதி தனிமங்கள்:
இத்தொகுதி தனிமங்கள் அட்டவணையில் 3 முதல் 12 தொகுதிகள் வரை இடம்பெற்றுள்ளன. இத்தொகுதி தனிமங்களின் கடைசி எலக்ட்ரான் ஆனாது d துணைக்கூட்டில் வைக்கப்படுகிறது. மேலும் இவை தனிம அட்டவணையின் மையத்தில் காணப்படுகின்றது. இவற்றின் பண்புகள் s தொகுதி மற்றும் p தொகுதி தனிமங்களுக்கு இடையில் உள்ளது. எனவே, இவை இடைநிலைத் தனிமங்கள் எனவும் அழைக்கப்படுகின்றது.
f - தொகுதி தனிமங்கள்:
இத்தொகுதி தனிமங்களின் கடைசி எலக்ட்ரான் ஆனாது f துணைக்கூட்டில் வைக்கப்படுகிறது. இவை லாந்தனத்தை அடுத்துள்ள 14 தனிமங்களையும் (லாந்தனைடுகள்), ஆக்டினத்தை அடுத்துள்ள 14 தனிமங்களையும் (ஆக்டினைடுகள்) உள்ளடக்கியதாகும். எனவே, இவை உள் இடைநிலைத் தனிமங்கள் எனவும் அழைக்கப்படுகின்றது. மேலும் இவை தனிம அட்டவணையின் அடிப்பாகத்தில் காணப்படுகின்றது.