PDF chapter test TRY NOW
ஒரு குறிப்பி்டத்தக்க நிறை மற்றும் பருமனை பெற்றுள்ள பொருள்கள் பருபொருள்கள் என்று உங்களுக்கு ஏற்கனவே தெரியும் அதனை இங்கு மீண்டும் நினைவு படுத்திக்கொள்வோம்.


பருபொருள்களின் பண்பு
பருபொருள்கள் என்றால் என்ன?
பருபொருள்களின் வெவ்வேறு நிலை யாது?
பருபொருள்கள் தொடர்ச்சியானதா அல்லது துகள் அமைப்பானதா?
பருபொருள்களின் வெவ்வேறு நிலை யாது?
பருபொருள்கள் தொடர்ச்சியானதா அல்லது துகள் அமைப்பானதா?
இதுபோன்ற பல்வேறு வினக்களுக்கான விடைகளை இப்பாடபிரிவில் தெளிவாகவும் மற்றும் விளக்கமாகவும் தெரிந்து கொள்வோம்.
ஒரு பருபொருளை சிறுத் துகள்களாக பகுக்கும் போது இறுதியில் மேலும் பகுக்க முடியாத மிகச் சிறிய துகள் உண்டாகின்றன. இந்த துகள்கள் அணுக்களாகவோ, மூலக்கூறுகளாகவோ அல்லது அயணிகளாகவோ இருக்கலாம்.
பருபொருள்கள் அணுக்களின் கூட்டமைப்பாகும். இவ்வமைப்பில் உள்ள வெவ்வேறு வகையான அணுக்கள் மற்றும் வெவ்வேறு வகையான இயற்பண்புகள் மற்றும் வேதிபண்புகளை கொண்டிருக்கும்.
அணுக்கள் இணைந்து மூலக்கூறுகளை உண்டாக்கும் என்று உங்களுக்கு ஏற்கனவே தெரியும். இந்த இணைப்பு ஒரு வேதிவினை எனப்படும். இதனை சமன்படுத்தி வேதி சமன்பாடுகளை கொண்டு குறியீடாக குறிக்கலாம்.
இப்பொழுது கீழே உள்ள சமன்பாட்டினை காண்போம். இதிலிருந்து நீங்கள் புரிந்து கொள்வது யாது? சோடியம், குளோரினும் இனைந்து சோடியம் குளோரிடை உண்டாக்குகிறது.
2Na + Cl_2 → 2NaCl
கூடுகை வினை:
இரண்டு அல்லது அதற்கு மேற்ப்பட்ட பொருள்கள் ஒன்று சேர்ந்து ஒரு பொருளை உருவாக்கும் வினை கூடுகை வினை எனப்படும்.
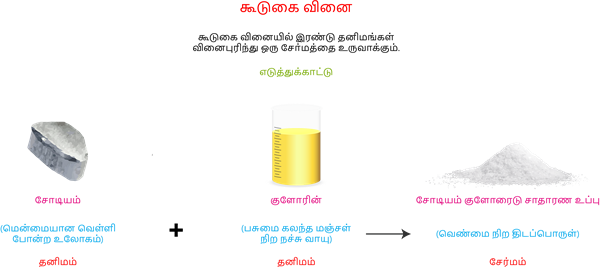
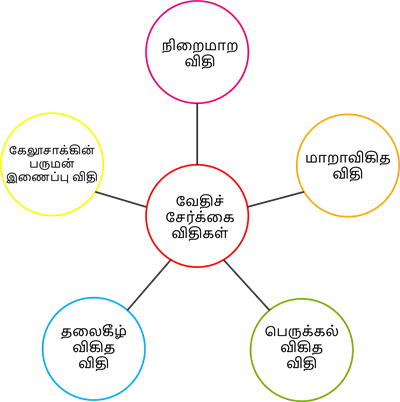
வெவ்வேறு தனிமங்கள் சேர்ந்து ஒரு சேர்மத்தை உருவாக்கும் கூடுகை வினையானது சில அடிப்படை விதிக்குட்ப்பட்டு நடைபெறுகிறது இந்த விதி வேதிசேர்க்கை விதியாகும்.
வேதிசேர்க்கை விதி ஐந்து வகைகளாக பிரிக்கலாம், அவை
- நிறைமாற விதி
- மாறாவிகித விதி
- பெருக்கல் விகித விதி
- தலைகீழ் விகித விதி
- கேலூசாக்கின் பருமன் இணைப்பு விதி