PDF chapter test TRY NOW
ஓர் அணுவின் வெளிக்கூடு இணைதிறன் கூடு என்றும் அதிலுள்ள எலக்ட்ரான்கள் இணைதிறன் எலக்ட்ரான்கள் என்றழைக்கப்படுகின்றன.
எடுத்துக்காட்டக கீழே உள்ள படத்தின் வெளிக்கூட்டில் எத்தனை எலக்ட்ரான்கள்
உள்ளது?

மேலே உள்ள படத்தின் வெளிக்கூட்டில் உள்ள இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கை 1.
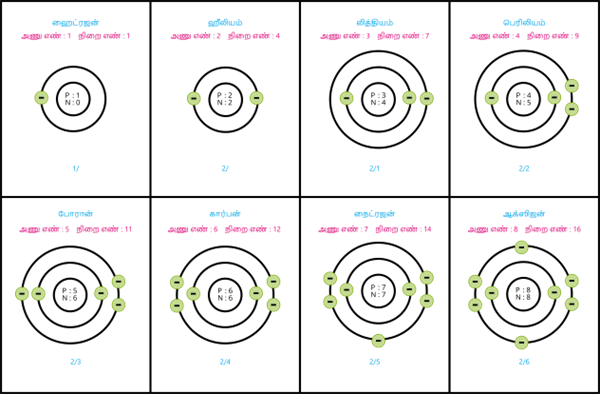
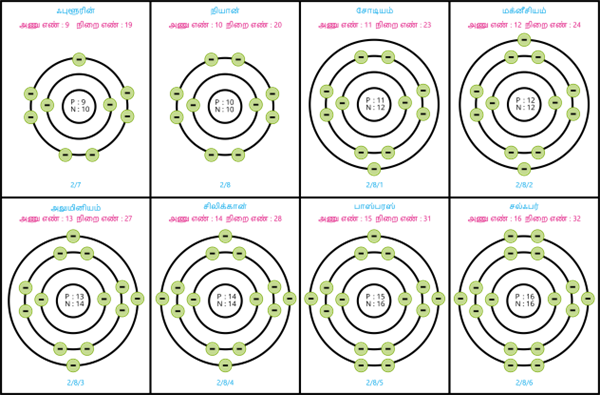
அணுவின் உட்கருவிலிருந்து கடைசியாக
உள்ள வெளிக்கூடு இணைதிறன் கூடு என்றும்,
அதிலுள்ள எலக்ட்ரான்கள் இணைதிறன் எலக்ட்ரான்கள் என்றும் அழைக்கப்படுகின்றன.
ஹைட்ரஜன் அணுவின் வெளிக்கூட்டில் ஒரு எலக்ட்ரான் மட்டுமே உள்ளது. எனவே அது ஒரு இணைதிறன்
எலக்ட்ரானை பெற்று உள்ளது. அதுபோலவே
கார்பனுக்கு வெளிக்கூட்டில் நான்கு
எலக்ட்ரான்கள் உள்ளன. எனவே அதற்கு நான்கு இணைதிறன் எலக்ட்ரான்கள்
உள்ளன. தனிமங்களின் வேதிப்பண்புகள்
அவற்றின் இணைதிறன் எலக்ட்ரான்களால் நிர்ணயிக்கப்படுகின்றன. ஏனெனில் அவை
மட்டுமே வேதி வினையில் பங்குபெறுகின்றன.
வெளிக் கூட்டில் சம எண்ணிக்கையில்
எலக்ட்ரான்களை கொண்ட தனிமங்கள் ஒரே
மாதிரியான பண்புகளை பெற்று இருக்கும்.
வேறுபட்ட எண்ணிக்கையில் இணைதிறன்
எலக்ட்ரான்களை உடைய தனிமங்கள்
வெவ்வேறு பண்புகளை பெற்று இருக்கும்.
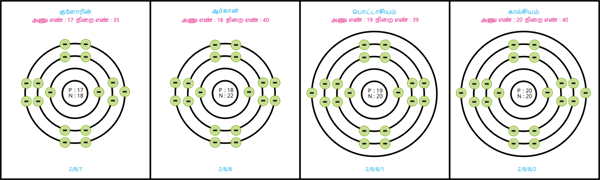
1 அல்லது 2 அல்லது 3 இணைதிறன் எலக்ட்ரான்களை கொண்ட தனிமங்கள் (ஹைட்ரஜனைத் தவிர்த்து) உலோகங்கள் என்றழைக்கப்படுகின்றன. இது போன்ற தனிமங்கள், எலக்ட்ரான்களை இழந்து நேர் மின்னூட்டங்களைக் கொண்ட அயனிகளை உருவாக்கும். அவையே எதிர் அயனிகள்.
Example:
Na - e (2,8,1), Na (2,8)
இணைதிறன் கூடு (அல்லது) வெளிக்கூட்டில் 4 முதல் 7 எலக்ட்ரான்கள் வரை கொண்ட தனிமங்கள் அலோகங்கள் என்றழைக்கப்படுகின்றன. இது போன்ற தனிமங்கள் எலக்ட்ரான்களைப் ஏற்று எதிர் மின்னூட்டங்களைக் கொண்ட அயனிகளை உருவாக்கும். அவையே நேர் அயனிகள்.
Example:
1 + e - (1- 7 இணைதிறன் எலக்ட்ரான்களைக் கொண்டிருக்கும்) (2,8,7) (2,8,8).
