
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demoஒரு தனிமத்தின் இணைதிறன் என்பது அத்தனிமம் மற்றொரு தனிமத்துடன் இணையும் திறனின் அளவு ஆகும்.
மேலும், அது வேதி வினையில் இடம் பெறும்
எலக்ட்ரான் எண்ணிக்கைக்கு நிகராக
இருக்கும். 1,2,3,4 போன்ற இணைதிறன்
எலக்ட்ரான்களை உடைய தனிமங்களின்
இணைதிறன் 1,2,3,4 ஆகவே இருக்கும். ஒரு
தனிமத்தின் இணைதிறன் எலக்ட்ரான்கள்
5,6,7 ஆக இருந்தால் அதன் இணைதிறன்
3,2,1 ஆகவே இருக்கும். அதாவது அணு
நிலைப்புத்தன்மையை அடைய தேவையான 8 எலக்ட்ரான்களை பெற, முறை 3,2,1
எலக்ட்ரான்கள் தேவைப்படுகின்றன.
அணுவின் வெளிக்கூடு முழுமையாக
எலக்ட்ரான்களால் நிரப்பப்பட்டிருப்பின்,
அத்தனிமத்தின் இணைதிறன் பூஜ்ஜியம் ஆகும்.
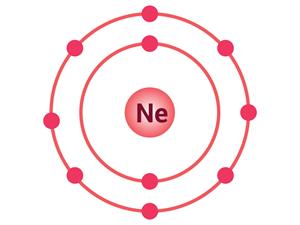
நியானின் எலக்ட்ரான் அமைப்பு
எடுத்துகாட்டாகா நியானின் எலக்ட்ரான் வடிவமைப்பு முறையே (2,8) ஆகும். அதனால் அதன் இணைதிறன் பூஜ்ஜியம் ஆகும்.
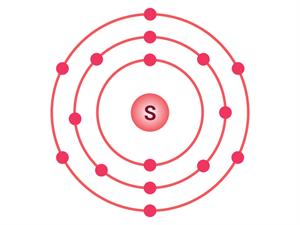
சல்ஃபரின் எலக்ட்ரான் அமைப்பு
மெக்னீசியம் மற்றும் சல்ஃபரின்
இணைதிறனை குறிப்பிடுதல்.
மெக்னீசியத்தின் எலக்ட்ரான் வடிவமைப்பு (2,8,2) அதனால் அதன் இணைதிறன் 2.
சல்ஃபரின் எலக்ட்ரான் வடிவமைப்பு (2,8,6) அதனால் அதன் இணைதிறன் 6.
குவாண்டம் எண்கள்:
அணுக்களின் கூடுகளை K,L,M,N
என்றும், அவற்றின் துணைக்கூடுகளை
s,p,d,f என்றும் பெயரிடுவோம்.
எலக்ட்ரான்கள் ஒரு சில விதிகளுக்குட்பட்டு
கூடுகளில் நிரம்புகின்றன. நாம் இப்பொழுது
ஓர் அணுவின் எலக்ட்ரான்களை
தனித்தன்மை பெறும்படி வடிவமைக்கலாமா?

அணுக் கூடு
அணுவில் உள்ள ஒவ்வொரு எலக்ட்ரானின்
தனித்தன்மையை அதன் நான்கு குவாண்டம்
எண்களின் அடிப்படையிலேயே அமையும்.
அணுவின் உள்ளிருக்கும் அணு ஆர்ப்பிட்டல் மற்றும் எலக்ட்ரான்களின் வடிவமைப்பு மற்றும் வேறுபாட்டை குறிக்கும் எண்கள் “குவாண்டம் எண்கள்” எனப்படும்.
இரண்டு எலக்ட்ரான்கள் ஒரே குவாண்டம்
எண்களைப் பெறுவது இல்லை.
குவாண்டம் எண் ஒரு எலக்ட்ரானின்
குணாதிசயங்களைக் குறிப்பிடும். எப்படி நம்
கட்டடத்தைக் காண்பிக்க நான்கு வழிகள்
உள்ளதோ (நாடு, மாநிலம், நகரம் மற்றும்
தெரு முகவரி) அதே போல் எலக்ட்ரானின்
பண்புகளை எடுத்துக் கூற நான்கு வழிகள்
உள்ளது. அதாவது நான்கு குவாண்டம் எண்கள்
ஆகும்.
குவாண்டம் எண்கள் நமக்கு உணர்த்துவது:
(i). உட்கருவிலிருந்து எலக்ட்ரானின் தொலைவு - (முதன்மைக் குவாண்டம்
எண் :: குறியீடு n :: முதன்மை ஆற்றல் மட்டம்).
(ii). அதனால் சூழப்பட்டிருக்கும் கூடு
மற்றும் அதன் வடிவம் - (கோண உந்தக்
குவாண்டம் எண் :: குறியீடு l :: துணைக் கூடு/ஆர்பிட்டல் வடிவம்).
(iii). இந்த கூடுகள் அணுவெளியில் எவ்வாறு
அமைந்துள்ளன - (காந்தக் குவாண்டம்
எண் :: குறியீடு m :: ஆர்பிட்டல் அமைவிடம்).
(iv). எலக்ட்ரான் எவ்வகையான சுழற்சியை
கொண்டுள்ளது - (சுழற்சி குவான்டம்
எண் :: குறியீடு s :: எலக்ட்ரான்களின் சுழற்சி).
இதைப் பற்றி மேலும் விரிவாக உயர் வகுப்புகளில் தெரிந்து கொள்வீர்கள்.