
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demoஒரு தனிமத்தின் அணு எண் (Z) ஆனது அவற்றிலுள்ள புரோட்டான்களின் (நேர் மின் சுமை) எண்ணிக்கையை மட்டும் குறிப்பதில்லை அவற்றிலுள்ள எலக்ட்ரான்களின் (எதிர் மின் சுமை) எண்ணிக்கையையும் குறிப்பிடுகிறது. தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் அவற்றின் புரோட்டான்களின் எண்ணிக்கையச் சார்ந்தவை அல்ல; மாறாக எலக்ட்ரான்களின் எண்ணிக்கையையும் சார்ந்ததே ஆகும். எனவே நவீன ஆவர்த்தன விதியை இவ்வாறு கூறலாம்.
“தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் அவற்றின் அணு எண்களின் தனிம வரிசை செயல்பாடுகளாகும்”.
நவீன தனிம வரிசை அட்டவணை:
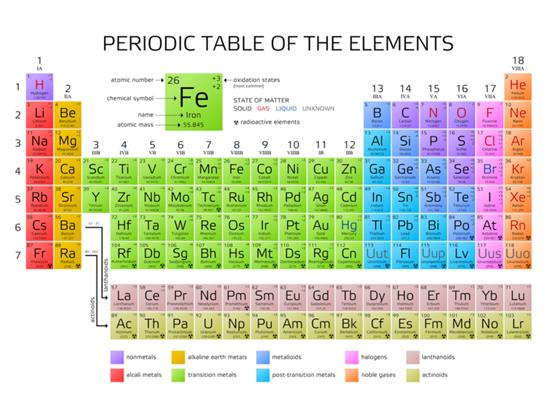
இந்த நவீன விதியை வைத்து நவீன தனிம வரிசை அட்டவணை உருவாக்கப்பட்டது.
நீள் வரிசை தனிம அட்டவணை அமைப்பின் சிறப்புகள்:
- அனைத்துத் தனிமங்களும் அவற்றின் அதிகரிக்கும் அணு எண்ணிற்கு ஏற்றது போல அமைக்கப்பட்டுள்ளன.
- தனிம அட்டவணையில் தனிமங்கள் கிடைமட்டமாக வரிசைப்படுத்தப்பட்ட அமைப்பு 'தொடர்கள்' என்று அழைக்கப்படுகிறது. மொத்தம் ஏழு தொடர்கள் உள்ளன.
- தனிமங்கள் அவற்றின் அணுக்களில் உள்ள கூடுகளின் எண்ணிக்கைகளுக்கு ஏற்ப வரிசைகளில் அமைக்கப்படும்.
- தனிம வரிசை அட்டவணையில் மேலிருந்து கீழாக செங்குத்தாக உள்ள பத்தி 'தொகுதிகள்' என்று அழைக்கப்படுகிறது. தனிம அட்டவணையில் 18 தொகுதிகள் உள்ளன.
- ஒவ்வொரு தொகுதியிலும் உள்ள தனிமங்களின் அவற்றின் பண்பிற்கு ஏற்ப இவை பல குடும்பங்களாகப் பிரிக்கப்பட்டுள்ளன.
நவீன தனிம வரிசை தொகுதிகள்:
|
குழு
|
தொகுதிகள்
|
|
1
|
கார உலோகங்கள்
|
|
2
|
கார மண் உலோகங்கள்
|
|
3 to 12
|
இடைநிலை உலோகங்கள்
|
|
13
|
போரான் குடும்பம்
|
|
14
|
கார்பன் குடும்பம்
|
|
15
|
நைட்ரஜன் குடும்பம்
|
|
16
|
ஆக்ஸிஜன் (அ) சால்கோஜன் குடும்பம்
|
|
17
|
ஹாலஜன்கள் / உப்பீனிகள்
|
|
18
|
அரிய வாயு / மந்த வாயு
|