
PUMPA - SMART LEARNING
எங்கள் ஆசிரியர்களுடன் 1-ஆன்-1 ஆலோசனை நேரத்தைப் பெறுங்கள். டாப்பர் ஆவதற்கு நாங்கள் பயிற்சி அளிப்போம்
Book Free Demoஅணு எண்
ஒரு அணுவில் உள்ள எலக்ட்ரான்கள் அல்லது புரோட்டான்களின் மொத்த எண்ணிக்கையே அந்த அணுவின் அணு எண் ஆகும். இது Z என்ற எழுத்தால் குறிக்கப்படுகிறது.
ஓர் அணுவின் அணு எண் தெரியுமானால் அவ்வணுவில் காணப்படும் எலக்ட்ரான்கள் அல்லது புரோட்டான்களின் எண்ணிக்கையை நம்மால் கண்டறிய இயலும்.
Example:
- ஹைட்ரஜன் அணுக்கருவானது ஒரே ஒரு புரோட்டானைக் கொண்டுள்ளது. அணுக்கருவிற்கு வெளியே ஒரு எலக்ட்ரான் மட்டுமே சுற்றி வருகிறது. எனவே ஹைட்ரஜனின் அணு எண் (Z) 1 ஆகும்.
- ஹீலியம் அணுவானது அதன் அணுக்கருவினுள் இரண்டு புரோட்டான்களையும் அணுக்கருவிற்கு வெளியே இரண்டு எலக்ட்ரான்களையும் கொண்டுள்ளது. எனவே, அதன் அணு எண் (Z) 2 ஆகும்.
படத்தில் கொடுக்கப்பட்ட ஆக்சிஜனின் அணு அமைப்பினைக் காணவும். அதன் அணு எண் யாது?
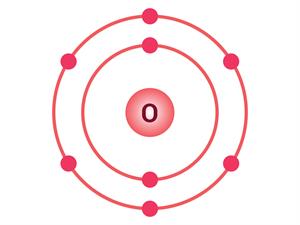
Example:
ஆக்சிஜன் அணுக்கருவானது 8 புரோட்டானைக் கொண்டுள்ளது. அணுக்கருவிற்கு வெளியே 8 எலக்ட்ரான் மட்டுமே சுற்றி வருகிறது. எனவே ஆக்சிஜனின் அணு எண் (Z) 8 ஆகும்.
நிறை எண் (A) அல்லது அணு நிறை
ஒரு அணுவின் மொத்த நிறையும் அதன் அணுக்கருவினுள் காணப்படும்.
நிறை எண் என்பது அணுக்கருவினுள் உள்ள மொத்த புரோட்டான்கள் மற்றும் நியூட்ரான்களின் எண்ணிக்கையின் கூடுதலுக்குச் சமமாகும். நிறை எண் அல்லது அணுநிறை = புரோட்டான்களின் எண்ணிக்கை + நியூட்ரான்களின் எண்ணிக்கை (A = p + n).
Example:
- லித்தியம் அணுவானது 3 புரோட்டான்களையும், 4 நியூட்ரான்களையும் கொண்டுள்ளது. எனவே, அதன் நிறை எண் (A) = 3 + 4 = 7.
- சோடியம் அணுவானது 11 புரோட்டான்களையும் 12 நியூட்ரான்களையும் கொண்டுள்ளது. எனவே, அதன் நிறை எண் (A) = 11 + 12 = 23.
ஒரு தனிமத்தின் குறியீட்டை எழுதும்போது, அவற்றின் அணு எண் மற்றும் நிறை எண்ணும் எழுதப்படும்.
Example:
ஹைட்ரஜன், கார்பன் மற்றும் ஆக்சிஜனின் குறியீடுகள் , , என்று எழுதப்படுகின்றன.