PDF chapter test TRY NOW
வாயுக்கள் வினைபுரியும் போது, அவற்றின் பருமன்கள் அவ்வினையின் விளைபொருள்களின் பருமனுக்கு எளிய முழு எண் விகிதத்தில் இருக்கும் (வாயுக்களின் பருமன்கள் ஒரே வெப்பநிலை மற்றும் அழுத்தத்தில் அளவிடப்படும் பட்சத்தில்). இவ்விதி கேலூசாக்கின் பருமன் இணைப்பு விதி எனப்படும்.

கேலூசாக்கின் பருமன் இணைப்பு விதிக்கு எடுத்துகாட்டு I
படி i: ஹைட்ரஜன் ஆக்சிஜனுடன் சேர்ந்து நீரை கொடுக்கின்றது.
படி ii: H_2 + O_2 → H_2O.
படி iii: 2H_2 (வா) + O_2 (வா) → 2H_2O (வா).
அதாவது இரண்டு பருமன்கள் கொண்ட ஹைட்ரஜன் ஒரு பருமன் கொண்ட ஆக்ஸிஜனுடன் இனைந்து இரண்டு பருமன்கள் கொண்ட நீராவியை உண்டாக்குகின்றது.
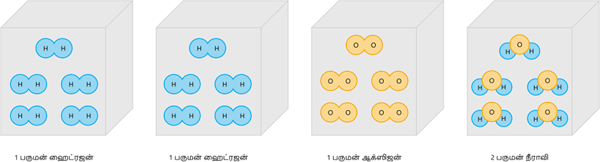
கேலூசாக்கின் பருமன் இணைப்பு விதிக்கு எடுத்துகாட்டு II
அதாவது, பருமனில் வாயு 2:1:2 என்ற முழு எண் விகிதத்தில் இருக்கிறது. இது, கொடுக்கப்பட்ட வெப்பநிலை மற்றும் அழுத்தத்தில், வினைபுரியும் எல்லா வாயுக்களின் பருமன் மற்றும் வினை பொருள்களின் பருமன் உடன் எளிய முழு எண் விகிதத்தில் இருப்பதை காட்டுகிறது.
இதேபோல மேலும் ஒரு எடுத்துக்காட்டை இங்கு காண்போம்.
படி i: ஹைட்ரஜன் குளோரினுடன் சேர்ந்து ஹைட்ரஜன் குளோரைடை கொடுக்கின்றது.
படி ii: H_2 + Cl_2 → 2HCl.
படி iii: H_2 (வா) + Cl_2 (வா) → 2HCl (வா).
1 பருமன் + 1 பருமன் → 2 பருமன்கள்
1:1:2
அதாவது ஒரு பருமன் ஹைட்ரஜன் ஒரு பருமன் குளோரினுடன் வினைபுரிந்து இரண்டு பருமன்கள் ஹைட்ரஜன் குளோரைடை வாயுவை உருவாக்குகின்றது.
அதாவது வாயுக்களின் பருமன் 1:1:2 என்ற எளிய முழு எண் விகிதத்தில் உள்ளது.
தீர்வு கணக்கு:
மீத்தேன் ஆக்ஸிஜனில் எரிந்து கார்பன் டை ஆக்ஸைடையும் மற்றும் நீராவியையும் உருவாக்குகிறது. இது பின்வரும் சமன்பாட்டின் படி கொடுக்கப்பட்டுள்ளது.
CH_4 (வா) + 2O_2 (வா) → CO_2 (வா) + 2H_2O (வா)
கணக்கீடு:
(i). 50 செ.மீ, 3 மீத்தேன் எரிவதற்கு தேவைப்படும் ஆக்ஸிஜனின் பருமன் மற்றும்
(ii). இந்த வினையில் உண்டான கார்பன் டை ஆக்ஸைடின் பருமனை கணக்கிடுதல்.
CH_4(வா) + 2O_2(வா) → CO_2(வா) + 2H_2O(வா)
1 பருமன் + 2 பருமன்கள் → 1 பருமன் + 2 பருமன்கள்
1 x 50 Cm^3 + 2 x 50 Cm^3 → 1 x 50 Cm^3 + 2 x 50 Cm^3
50 Cm^3 + 100 Cm^3 → 50 Cm^3 + 100 Cm^3
பயன்படுத்தப்பட்ட மொத்த ஆக்ஸிஜனின் பருமன் = 100 Cm^3
உருவாகும் மொத்த கார்பன் டை ஆக்ஸைடின் பருமன் = 50 Cm^3
